جواب تمرین های دوره ای فصل ۲ شیمی دوازدهم 👩🔬صفحه ۶۳ تا ۶۶

در این نوشته باجواب تمرین های دوره ای فصل ۲ شیمی دوازدهم همراه شما هستیم.
جواب صفحه ۶۳ شیمی دوازدهم
۱ برای هر یک از جملههای زیر، دلیلی بنویسید.
آ) فلز پلاتین را میتوان در بخشهای مختلف بدن هنگام جراحی به کار برد.
فلز پلاتین جزو فلزهای نجیب است. این فلز به دلیل داشتن $E{}^\circ$ بزرگ، تمایلی برای از دست دادن الکترون و شرکت در واکنشهای شیمیایی ندارد، بنابراین با الکترولیتها مواد موجود در بدن واکنش نمیدهد.
ب) فلوئور، اکسندهترین عنصر در جدول دورهای است.
فلوئور $({{F}_{2}}(g))$ به عنوان فعالترین نافلز جدول دورهای تمایلی به دادن الکترون ندارد، بلکه تمایل بسیار زیاد برای گرفتن الکترون و کاهش یافتن دارد، بنابراین قدرت اکسندگی زیادی هم دارد.
$E{}^\circ ({{F}_{2}}/F)=+2/8V$
پ) عدد اکسایش اکسیژن در OF۲ برابر با ۲+ است.

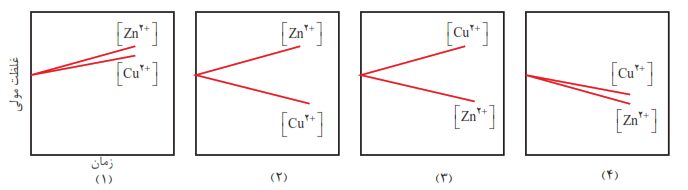
۲- با مراجعه به جدول ۱، توضیح دهید کدام نمودار تغییر غلظت یونها را در سلول گالوانی روی – مس در بخشی از زمان نشان میدهد.
نمودار ۲ تغییر غلظت یونها را در سلول گالوانی روی – مس به درستی نشان داده است.
کاتد $E{}^\circ (C{{u}^{2+}}/Cu)=+0/34V $ $,$ آند $E{}^\circ (Z{{n}^{2+}}/Zn)=-0/76V$
با گذشت زمان در سلول گالوانی غلظت کاتیون در نیم سلول آندی زیاد خواهد شد. $[Z{{n}^{2+}}]\Leftarrow $ افزایش مییابد. (در نمودارهای ۳ و ۴) در نیم سلول کاتدی، کاتیونهای موجود در محلول الکترولیت با دریافت الکترون، کاهش یافته به اتم خنثی تبدیل میشود. $[C{{u}^{2+}}]\Leftarrow$ کاهش مییابد در نمودار (۱)
۳- emf سلولی که واکنش زیر در آن رخ میدهد برابر با $۱/98V$ است. $E{}^\circ $ نیم سلول $A$ را حساب کرده و با مراجعه به جدول ۱ مشخص کنید $A$ کدام فلز است؟
$A(s) + 2A{g^ + }(aq) \to {A^{2 + }}(aq) + 2Ag(s)$

فلز منگنز $=-1/18V\Rightarrow A\Rightarrow (Mn)$ (آند) $\Rightarrow E{}^\circ$ (آند) $\Rightarrow 1/98=0/8-E{}^\circ $ (آند) $-{{E}^{{}^\circ }}$ (کاتد) $emf=E{}^\circ $
۴- عدد اکسایش اتم نشان داده شده با ستاره را مشخص کنید.

۵- در هر یک از واکنشهای زیر گونههای اکسنده و کاهنده را مشخص کنید.

۶- باتری های روی – نقره از جمله باتریهای دگمهای هستند که در آنها واکنش زیر انجام میشود:
$Zn(s) + A{g_2}O(s) \to ZnO(s) + 2Ag(s)$
آ) گونههای اکسنده و کاهنده را در آن مشخص کنید.
اکسنده: نقره (Ag) کاهنده: روی (Zn)
ب) آند و کاتد را در این باتری مشخص کنید.
آند: روی (Zn) و کاتد: نقره (Ag)
جواب صفحه ۶۴ شیمی دوازدهم
۷- با توجه به جدول زیر به پرسشها پاسخ دهید.
| $E{}^\circ (V)$ | نیمواکنش کاهش |
|---|---|
| $+۱/۳۳$ | ${{A}^{+}}(aq)+{{e}^{-}}\to A(s)$ |
| $+۰/۸۷$ | ${{B}^{2+}}(aq)+2{{e}^{-}}\to B(s)$ |
| $-۰/۱۲$ | ${{C}^{3+}}(aq)+{{e}^{-}}\to {{C}^{2+}}(aq)$ |
| $-۱/۵۹$ | ${{D}^{3+}}(aq)+3{{e}^{-}}\to D(s)$ |
آ) کدام گونه قویترین و کدام ضعیفترین اکسنده است؟
قویترین اکسنده: $A$ چون بیشترین $E{}^\circ $ را دارد.
ضعیفترین اکسنده: $D$ چون کمترین $E{}^\circ $ را دارد.
ب) کدام گونه قویترین و کدام ضعیفترین کاهنده است؟
قویترین کاهنده: $D$ و ضعیفترین کاهنده: $A$
پ) کدام گونه(ها)${{C}^{2+}}$ را اکسید کنند؟
گونهٔ اکسیدکننده (اکسنده) باید خودش کاهش پیدا کند. $\leftarrow $ باید $E{}^\circ $ بزرگتر نسبت به ${{C}^{2+}}$ داشته یاشد. $\leftarrow $ گونههای $A$ و $B$ میتوانند ${{C}^{2+}}$ را اکسید کنند.
۸- با توجه به واکنشهای زیر به طور طبیعی انجام میشوند گونههای کاهنده و گونههای اکسنده را بر حسب کاهش قدرت مرتب کنید؟
$2C{{r}^{2+}}(aq)+S{{n}^{2+}}(aq)\to 2C{{r}^{3+}}(aq)+Sn(s)$

۹- با توجه به جدول پتانسیلهای کاهشی استاندارد توضیح دهید محلول هیدروکلریک اسید را در کدام ظرف (مسی یا آهنی) میتوان نگه داشت؟
ظرف مسی مناسب است. به طور کلی برای نگه داری محلولها جنس ظرف باید از فلزی انتخاب شود که جایگاه آن در جدول پتانسیل کاهشی استاندارد بالاتر از کاتیون موجود در محلول باشد، پس برای نگهداری محلول رقیق اسیدها باید ظرفی را انتخاب کرد که $E{}^\circ $ آن را بالاتر از هیدروژن باشد $(E{}^\circ \gt 0)$.
۱۰- قدر مطلق پتانسیل کاهشی دو عنصر X و Y در زیر داده شده است. هنگامیکه این دو نیمسلول را به هم وصل میکنیم، جریان الکتریکی از اتم X به اتم Y برقرار میشود و با اتصال نیمسلول X به نیمسلول هیدروژن، الکترونها از اتم X به سمت نیمسلول هیدروژن جاری میشوند. نیروی الکتروموتوری سلول گالوانی شامل این دو نیمسلول را حساب کنید.
${{Y^{2 + }} + 2{e^ – } \to Y} , {\left| {{E^\circ }} \right| = 0/34V}$
${{X^{2 + }} + 2{e^ – } \to X} , {\left| {{E^\circ }} \right| = 0/25V}$
جواب صفحه ۶۵ شیمی دوازدهم
۱۱- شیمیدانها در برخی سلولهای الکتروشیمیایی برای انجام واکنش اکسایش – کاهش از نور بهره میبرند و آنها را سلول نور الکتروشیمیایی مینامند.
در نمونهای از آنها که برای تهیه گاز هیدروژن از آب به کار میرود، با توجه به نیمواکنشهای زیر:
$ {Si{O_2}(s) + 4{H^+}(aq) + 4e \to Si(s) + 2{H_2}O(l)} , {{E^\circ } = 0/84V} $
${۲{H_2}O(l) + 2e \to {H_2}(g) + 2O{H^ – }(aq)} , {{E^\circ } = 0/83V}$
آ) نیم سلول آند و کاتد را مشخص و emf سلول را حساب کنید.
نیمسلول آند: $Si{O_2}(s) + 4{H^ + }(aq) + 4{e^ – } \to Si(s) + 2{H_2}O(l)$
نیمسلول کاتد: $2{H_2}O(l) + 2e \to {H_2}(g) + 20{H^ – }(aq)$
$emf = 0/83 – ( – 0/84) = 0/01V$
ب) یافتههای تجربی نشان میدهند که افزون بر emf، بازده و سرعت انجام واکنش در این سلول پایین است، با این توصیف چرا برخی استفاده از آنها را برای تهیه گاز هیدروژن مناسب میدانند؟
زیرا گاز ${H_2}$ (هیدروژن)، گاز خطرناکی است و تحت کنترل تولید میشود.
۱۲- در یک آزمایش چهارفلز C ،B ،A و D رفتارهای زیر را نشان دادهاند:
– فقط فلزهای A و C با محلول ۰/1M هیدروکلریک اسید واکنش میدهند و گاز هیدروژن تولید میکنند.
– با قرار دادن فلز C در محلولهای حاوی یونهای ${D^{2 + }}$، ${B^{2 + }}$ و ${A^{2 + }}$ به ترتیب فلزهای D و B و A رسوب میکنند.
– یون ${B^{2 + }}$ اکسنده قویتری از ${D^{2 + }}$ است.
با توجه به این دادهها، ترکیب کاهندگی این چهار فلزر را مشخص کنید.
از بند (۱) متوجه می شویم که فلزهای A و C از دیگر فلزها کاهنده تر هستند و می توانند الکترون های خود را از دست بدهند.
از بند (۲) متوجه می شویم که فلز C از فلز A کاهنده تر است و می تواند الکترون های خود را به یون A2+𝐴۲+
بدهد و آن را به فلز A تبدیل کند.
از بند (۳) متوجه می شویم که فلز D از فلز B کاهنده تر است.
بنابراین قدرت کاهندگی این چهار فلز به صورت زیر می باشد:
C > A > D > B
جواب صفحه ۶۶ شیمی دوازدهم
۱۳- جدول زیر نیروی الکتروموتوری سه سلول گالوانی را نشان میدهد:
| ${C^{2 + }}/C$ | ${B^{2 + }}/B$ | |
| $۰/58V$ | $۰/89V$ | ${A^{2 + }}/A$ |
| $۰/31V$ | – | ${B^{2 + }}/B$ |
اگر ${E^\circ }{C^{2 + }}/C = 0/00V$ و فلز A با یون ${C^{2 + }}$ واکنش ندهد:
از عبارت «فلز A با یون C+2𝐶+۲ واکنش ندهد» متوجه می شویم که فلز A اکسنده تر از فلز C می باشد؛ در نتیجه فلز A نقش کاتد را ایفا می کند و فلز C نقش آند را؛ بنابراین:
آ) مقدار پتانسیل کاهشی استاندارد را برای دو عنصر A و B بهدست آورید.
E∘(A2+/A)−E∘(C2+/C)=
E∘(A2+/A)−۰/00V=0/58V
⇒E∘(A2+/A)=0/58V
E∘(B2+/B)−E∘(C2+/C)=
E∘(B2+/B)−۰/00V=0/31V
⇒E∘(B2+/B)=0/31V
ب) نماد اکسندهترین و کاهندهترین گونه را بنویسید.
اکسنده ترین گونه فلز A می باشد و کاهنده ترین گونه، فلز C می باشد.
برای مشاهده گام به گام سایر صفحات کتاب کافیست آن را در گوگل به همراه عبارت «حالا درس» جست و جو کنید.
