جواب با هم بیندیشیم صفحه ۱۰۶ شیمی دوازدهم
در این نوشته با جواب با هم بیندیشیم صفحه ۱۰۶ شیمی دوازدهم همراه شما هستیم.
جواب با هم بیندیشیم صفحه ۱۰۶ شیمی دوازدهم
۱- جدول داده شده اثر دما را بر ثابت تعادل زیر نشان می دهد . با توجه به آن به پرسش ها پاسخ دهید.
آ) عبارت ثابت تعادل را برای آن بنویسید.

ب) میزان پیشرفت واکنش در کدام دما بیشتر است؟ چرا؟
دمای ۴۳۵∘C، زیرا K تعادل بزرگتر شده است، یعنی درصد بیشتری از مواد واکنشدهنده به فراورده تبدیل شده است.
پ) با افزایش دما K چه تغییری کرده است؟ این تغییر، جابه جا شدن تعادل را در چه جهتی نشان میدهد؟
با افزایش دما K بزرگتر شده است، یعنی تعادل در جهت واکنش رفت جابهجا شده است.
ت) اگر برای این واکنش ΔH>۰ باشد، جا به جا شدن تعادل و افزایش K را به کمک اصل لوشاتلیه توجیه کنید.
با افزایش دما و بزرگتر شدن K متوجه میشویم که تعادل گرماگیر است.
طبق اصل لوشاتلیه ¬ با افزایش دما (T) واکنش به سمت مصرف گرما پیش میرود و تعادل به سمت واکنش گرماگیر جابهجا میشود، یعنی تعادل به سمت واکنش رفت پیش میرود.
۲- با خط زدن واژه نادرست در هر مورد، عبارت زیر را کامل کنید.
هنگامی که دمای یک سامانه تعادلی افزایش مییابد، واکنش در جهت (مصرف / تولید) گرما پیش میرود، اگر این واکنش گرماگیر باشد مقدار (فراوردهها / واکنش دهندهها) در سامانه کاهش مییابد.
۳ــ نمودار زیر درصد مولی آمونیاک را برای سامانه تعادلی زیر در فشار ثابت نشان می دهد. باتوجه به آن به پرسش ها پاسخ دهید.
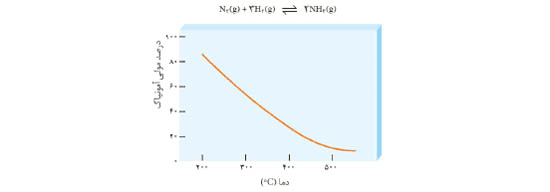
آ) با افزایش دما درصد مولی آمونیاک در سامانه چه تغییری می کند؟
کاهش مییابد.
ب) این واکنش گرماده است یا گرماگیر؟ چرا؟
واکنش گرماده است، زیرا با افزایش دما طبق اصل لوشاتلیه واکنش باید در جهت مصرف گرما (گرماگیر) پیش رود. با توجه به کاهش درصد مولی آمونیاک بر اثر افزایش دما متوجه میشویم که واکنش در جهت برگشت جابهجا شده است.

پ) مقدار ثابت تعادل آن در سه دمای ۲۵ ،۲۰۰ و ۴۰۰ درجه سلسیوس به صورت زیر است.
K۱ = ۶/۲ × ۱۰-۴ , K۲ = ۲/۲۴ , K۳ = ۶/۰ × ۱۰۵
کدام یک، ثابت تعادل را در دمای اتاق نشان می دهد؟ توضیح دهید.
K۱، مطابق نمودار در دمای اتاق درصد مولی آمونیاک بسیار ناچیز است، پس واکنش پیشرفت کمی داشته و K تعادل باید بسیار کوچک باشد.
برای مشاهده گام به گام سایر صفحات کتاب کافیست آن را در گوگل به همراه عبارت «حالا درس» جست و جو کنید.
