جواب تمرین های دوره ای فصل سوم شیمی دهم
در این نوشته با جواب تمرین های دوره ای فصل سوم شیمی دهم همراه شما هستیم.
جواب تمرین های دوره ای فصل سوم شیمی دهم
۱) اگر در محلول های آبی (۱) تا (۶) هر ذره حل شونده هم ارز با ۰/۰۲ مول باشد، به پرسش های زیر پاسخ دهید.
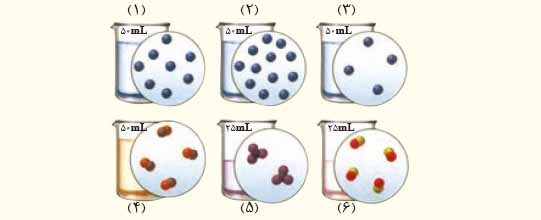
آ) کدام محلول غلیظ تر است؟ چرا؟
زیرا غلظت مولی (تعداد مول های حل شده در واحد حجم محلول) آن بیشتر است.
ب) غلظت مولی کدام محلول ها با هم برابر است؟
محلول های ۱ و ۶ و محلول های ۳ و ۴ و ۵.
پ) غلظت مولی محلول به دست آمده از مخلوط کردن محلول (۱) و (۳) را حساب کنید.

ت) غلظت مولی محلول (۴) را پس از افزودن ۱۱۰ میلی لیتر آب به آن حساب کنید.
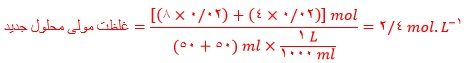
ث) غلظت مولی محلول (۵) را پس از انحلال ۰/۰۲ مول حل شونده به دست آورید (از تغییر حجم چشم پوشی کنید)
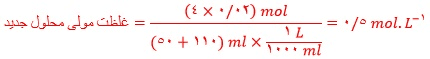
۲) ادامه زندگی اغلب ماهی ها هنگامی امکان پذیر است که غلظت اکسیژن محلول در آب بیشتر از ppm 5 باشد. با انجام محاسبه مشخص کنید که آیا ۹ کیلوگرم آب حاوی ۶۷/۵ میلی گرم اکسیژن محلول برای ادامه زندگی ماهی ها مناسب است؟
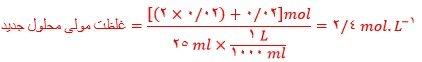
از آن جایی که میزان اکسیژن محلول در نمونه آب مورد نظر کمتر از ppm5 است پس برای حیات آبزیان مناسب نمی باشد.
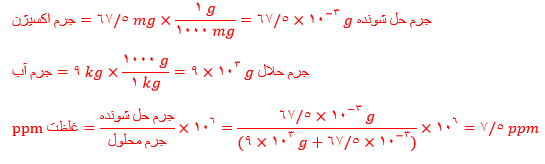
۳) با توجه به نمودار زیر به پرسش های مطرح شده پاسخ دهید. جرم مولی هر سه ماده آلی A و B و C با یکدیگر برابر است.
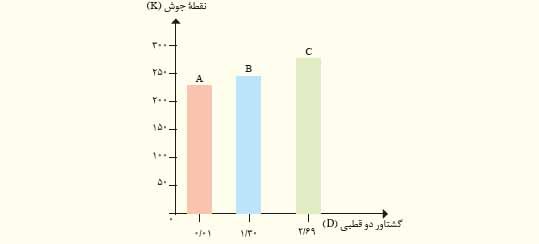
هر چه گشتاور دوقطیی مولکول ها سازنده ماده ای بزرگتر باشد ، مولکول های آن قطبی تر و با جرم مولی مشابه ، نیروهای بین مولکولی آن قوی تر است و دمای جوش آن ها نیز بالاتر.
آ) جهت گیری و منظم شدن مولکول های کدام ترکیب در میدان الکتریکی محسوس تر است؟ چرا؟
C – زیرا با توجه به داده های تجربی مولکول های آن قطبی تر است.
ب) سه ترکیب داده شده را بر اساس کاهش قدرت نیروهای بین مولکولی مرتب کنید؟
C > B > A
پ) پیش بینی می کنید کدام ماده در شرایط یکسان انحلال پذیری بیشتری در هگزان دارد؟ چرا؟
A – زیرامیزان قطبی بودن با گشتاور دو قطبی مولکول های آن کم بوده و می توان گفت ناقطبی اند پس ناقطبی مانند هگزان به میزان بیشتری حل می شود.
۴) در نمودار زیر انحلال پذیری گاز اکسیژن در آب آشامیدنی و آب دریا نشان داده شده است.
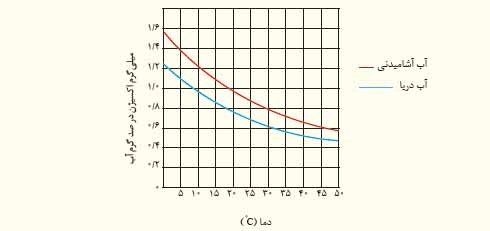
آ) در دمای ۵ درجه سانتی گراد انحلال پذیری گاز اکسیژن چقدر است؟
در آب آشامیدنی، ۱/۴ و در آب دریا، ۱/۱ است.
ب) با افزایش دما چه تغییری در مقدار حل شدن گاز اکسیژن مشاهده می شود؟
با افزایش دما از میزان انحلال پذیری اکسیژن، هم در آب آشامیدنی و هم در آب دریا کاسته می شود.
پ) آیا می توان گفت با افزایش مقدار نمک در آب، انحلال پذیری گاز اکسیژن کاهش می یابد؟ توضیح دهید.
بله – نمک ها ترکیب های یونی هستند که هنگام انحلال در آب، یون ها جاذبه های قوی یون – دوقطبی با مولکول های تشکیل می دهند، از این رو اغلب آن ها به خوبی در آب حل می شوند. حال اگر در یک نمونه آب، حل شونده های یونی به میزان زیادی حل شده باشند مولکول های آب تمایل کمتری برای انحلال مواد دیگر و نیز گازها دارد و می توان گفت انحلال ترکیب جامد در مایع راه خروج گازهای حل شده هموار کرده و گاز کمتری در مایع حل می شود.
توجه: افزودن نمک خوراکی به باطری محتوای نوشابه و خروج سریع و شدید گاز از آن، نشان می دهد که آب تمایل بیشتری به انحلال NaCl دارد، تا به انحلال گازهایی مانند O۲ – CO۲ همچنین ذرات جامد اگر در مایع حل شوند به خروج گاز از مایع کمک می کنند.
۵) هر یک از شکل های زیر نمایی از آغاز و پایان آزمایشی برای درک مفهوم انحلال پذیری سه ماده در آب و دمای ۲۵ درجه سانتی گراد است.
نتیجه هریک از این آزمایش ها را بنویسید.

ا)برخی مواد مانند شکر، انحلال پذیری معینی در آب با دمای ۲۵ درجه سانتی گراد دارند. یعنی با افزودن حل شونده بیشتر، انحلال تا پدید آمدن محلول سیر شده پیش می رود به طوری که در هر ۱۰۰ گرم آب ۲۵ درجه سانتی گراد، حداکثر ۲۰۵ گرم شکر حل شده و ۳۰۵ گرم محلول سیر شده پدید می آید و مطابق شکل ۹۵ گرم در ته ظرف به صورت حل شده باقی می ماند.
ب) برخی مواد مانند روغن (ترکیب های ناقطبی) در آب نا محلول هستند. یعنی به میزان بسیار ناچیز در آب حل می شوند یا به عبارت دیگر بلافاصله به محلول سیر شده تبدیل می شوند.
پ) برخی مواد مانند اتانول، به هر نسبتی در آب حل می شوند و هیچ گاه نمی توان از آن ها محلول سیر شده تهیه کرد. در واقع با افزایش بیشتر اتانول به آب به محلول هایی دست می یابیم که در آن ها میزان اتانول به حدی از آب آ بیشتر می شود که اتانول را حلال و آب را حل شونده در نظر می گیریم.
۶) هر یک از شکل های زیر، کاربردی از یک ترکیب یونی را نشان می دهد.

آ) کدام شکل کاربرد کلسیم سولفات و کدام شکل کاربرد آمونیوم نیترات را نشان می دهد؟ توضیح دهید.
کلسیم سولفات، ترکیب یونی جامد است که به عنوان گچ طبی به کار می رود و در حالی که آمونیوم نیترات یکی از کودهای شیمیایی محلول در آب است که برای رشد گیاهان مصرف می شود.
ب) اگر انحلال پذیری کلسیم سولفات و آمونیوم نیترات در آب و دمای ۲۰ درجه سانتی گراد به ترتیب برابر با ۰/۲ و ۶۵/۵ گرم باشد، درصد جرمی محلول سیرشده هریک را در این دما حساب کنید.
انحلال پذیری: جرم (گرم) حل شونده در ۱۰۰ گرم آب در دمای معینی را نشان می دهد. پس جرم محلول سیر نشده کلسیم سولفات و آمونیوم نیترات را به ترتیب ۱۰۰/۲ گرم و ۱۶۵/۵ گرم است از این رو:
۷) کوسه های شکارچی حس بویایی بسیار قوی دارند و می توانند بوی خون را از فاصله دورتر حس کنند. اگر یک قطره (۰/۱ گرم) از خون یک شکار در فضایی از آب دریا به حجم ۱۲۱۰ × ۴ لیتر پخش شود، این کوسه ها بوی خون را حس می کنند. حساب کنید حس بویایی این کوسه ها به حداقل چند ppm خون حساس است؟ ( جرم یک لیتر آب دریا را یک کیلوگرم در نظر بگیرید).

چون چگالی آب گرم بر میلی لیتر است لذا ۱۰۱۲×۴ لیتر آب دریا هم ارز یا ۱۰۱۲×۴ کیلوگرم از آن است.
این مقدار، حساسیت بسیار بالایی حس بویایی را نشان می دهد. زیرا ppm غلظتی است برای محلول های بسیار رقیق به کار می رود، اما این مقدار بسیار کوچکتر از ppm است.
توجه: روش آسانتر، نسبت میلی گرم حل شونده به هر متر مکعب محلول است به طوری که
(در صورتیکه محلول به حدی رقیق باشد که بتوان چگالی 1g.ml-۱باشد و 1000kg = 1m۳شود.)
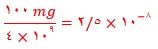
برای مشاهده گام به گام سایر صفحات کتاب کافیست آن را در گوگل به همراه عبارت «حالا درس» جست و جو کنید.

2 دیدگاه ها
سوال ۲ راه حل درست نوشته شده ولی نتیجه گیری اشتباهه:| میلی گرم بر روی کیلوگرم=ppm. پس ۷/۵ppm که بیشتر از ۵ppm است مناسب زندگی ماهیان میباشد توی خود سوال هم اومده که در صورتی که بیشتر از ۵ppm باشه ماهیا میتونن زندگی کنن
با عرض سلام و خسته نباشید.
جواب سوال 2 در پایین قسمت سوال 3 آمده است لطفا تصحیح شود.
با تشکر از شما