جواب با هم بیندیشیم صفحه ۴۰ شیمی دوازدهم

در این نوشته با جواب با هم بیندیشیم صفحه ۴۰ شیمی دوازدهم همراه شما هستیم.
جواب صفحه ۴۰ شیمی دوازدهم
اکسیژن نافلزی فعال است که با اغلب فلزها واکنش می دهد و آنها را به اکسید فلز تبدیل می کند، درحالی که با برخی فلزها مانند طلا و پلاتین واکنش نمی دهد. شکل زیر الگوی ساده ای از واکنش بین اتم های روی و اکسیژن را با ساختار لایه ای اتم نشان می دهد.
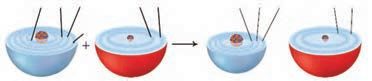
آ) کدام ساختار اتم روی و کدام یک اتم اکسیژن را نشان می دهد؟
از سمت چپ نخستین ساختار مربوط به اتم روی و دومین ساختار مربوط به اتم اکسیژن است .
ب) کدام اتم الکترون از دست داده و کدام الکترون گرفته است؟
اتم روی الکترون از دست داده و اتم اکسیژن الکترون گرفته است .
پ) اگر گرفتن الکترون را کاهش و از دست دادن الکترون را اکسایش بنامیم، کدام گونه کاهش و کدام اکسایش یافته است؟
اتم روی ، اکسایش و اتم اکسیژن ، کاهش یافته است .
اکسایش: از دست دادن الکترون
نکته
کاهش: به دست آوردن الکترون
ت) شیمی دان ها هریک از فرایندهای گرفتن و از دست دادن الکترون را با یک نیمواکنش نمایش می دهند که هر نیم واکنش باید از لحاظ جرم (اتم ها) و بار الکتریکی موازنه باشد. اینک با قرار دادن تعداد معینی الکترون، هریک از نیم واکنش های زیر را موازنه کنید.
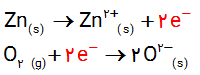
ث) کدام یک از نیم واکنش های بالا، نیم واکنش اکسایش و کدام یک نیم واکنش کاهش را نشان می دهد؟چرا؟
نیمواکنش اول مربوط به اکسایش روی است، زیرا اتم روی الکترون از دست داده و اکسایش پیدا کرده است. نیمواکنش دوم مربوط به کاهش اکسیژن است، زیرا اتم اکسیژن الکترون گرفته و کاهش پیدا کرده است.
ج) ماده ای که با گرفتن الکترون سبب اکسایش گونه دیگر می شود، اکسنده که با دادن الکترون سبب کاهش گونه دیگر می شود، کاهنده نام دارد. در واکنش روی با اکسیژن، گونه اکسنده و کاهنده را مشخص کنید
روی گونه کاهنده و اکسیژن گونه اکسنده است .
$Zn(s)\to Z{{n}^{2+}}(s)+……….$
نیمواکنش اکسایش $Zn(s)\to Z{{n}^{2+}}(s)+2_{e}^{-}$ کاهنده
${{O}_{2}}(g)+…………\to 2{{O}^{2-}}(s)$
نیمواکنش کاهش ${{O}_{2}}(g)+4_{e}^{-}\to 2{{O}^{2-}}(s)$ اکسنده
اغلب فلزها در واکنش با نافلزها تمایل دارند یک یا چند الکترون خود را به نافلزها داده و ضمن اکسایش به کاتیون تبدیل شوند. نافلزها نیز با گرفتن یک یا چند الکترون کاهش یافته و به آنیون تبدیل میشوند. از این رو فلزها اغلب کاهنده و نافلزها اغلب اکسنده هستند.
نکته
برای مشاهده گام به گام سایر صفحات کتاب کافیست آن را در گوگل به همراه عبارت «حالا درس» جست و جو کنید.
