جواب تمرین های دوره ای فصل ۱ شیمی دوازدهم 👨🔬صفحه ۳۳ تا ۳۶

در این نوشته با جواب تمرین های دوره ای فصل ۱ شیمی دوازدهم همراه شما هستیم.
جواب صفحه ۳۳ شیمی دوازدهم
۱ــ برای هر یک از موارد زیر دلیلی بیاورید.
آ) اسیدها و بازها با ثابت یونش کوچک، الکترولیت ضعیف به شمار می روند
ثابت یونش کوچک نشان دهنده میزان یونش کم و غلظت کم یون ها در محلول است .
ب) اغلب اسیدها و بازهای شناخته شده ضعیف هستند
اغلب اسیدهای شناخته شده ( آلی و معدنی ) ضعیف هستند به طوریکه مصرف خوراکی ها و داروها و همچنین استفاده از بسیاری پاک کننده های گوناگون ، این ویژگی را تأیید می کند .
پ) در محلول ۰/۱ مولار نیتریک اسید در دمای اتاق، [NO۳–]=۰/۱ mol.L-۱ است.
نیتریک اسید یک اسید قوی است . از این رو در محلول آن ، یونش به طور کامل رخ می دهد و به ازای یونش هر HNO۳ در محلول، یک یون هیدرونیوم و یک یون نیترات تولید می شود . پس :
$[HN{{O}_{3}}]=[{{H}^{+}}]=[NO_{3}^{-}]=0/1mol{{L}^{-1}}$
ت) در محلول ۰/۰۱ مولار فورمیک اسید [HCOOH]>[H+] است.
فورمیک اسید یک اسید ضعیف است از این رو در محلول به طور جزئی یونیده می شود در واقع مولکول های HCOOH به طور عمده به شکل یونیده نشده در محلول وجود دارند.
۲- کاغذ pH بر اثر آغشته شدن به نمونه ای از یک محلول، به رنگ سرخ در می آید . همچنین رسانایی الکتریکی این محلول در شرایط یکسان به طور آشکاری از محلول آبی سدیم کلرید کمتر است. این محلول محتوی کدام ماده حل شونده می تواند باشد؟ توضیح دهید.
CH۳OH , KOH , HCOOH , HCl , NH۳
رنگ سرخ کاغذ PH نشانه اسیدی بودن محلول است. رسانایی الکتریکی کم آن، محلول الکترولیت ضعیف را یادآوری میکند. این ویژگیهای محلول یک اسید ضعیف است که با HCOOH(aq) همخوانی دارد. HCl ، KOH و KBr الکترولیتهای قوی بوده اما CH۳OH غیر الکترولیت است. NH۳ با اینکه الکترولیت ضعیف است اما محلول آبی آن خاصیت بازی دارد.
رنگ سرخ کاغذ نشانه اسیدی بودن محلول است . رسانایی الکتریکی کم آن ، محلول الکترولیت ضعیف را یادآوری می کند .
۳- در دما و غلظت یکسان، هر یک از شکل های زیر به کدامیک از محلول ها تعلق دارد؟ چرا؟
آ( محلول استیک اسید ( Ka=1/8´۱۰-۵ ) .
ب( محلول هیدروبرمیک اسید ) Ka بسیار بزرگ ).
پ( محلول هیدروسیانیک اسید ( Ka=4/9´۱۰-۱۰ ).
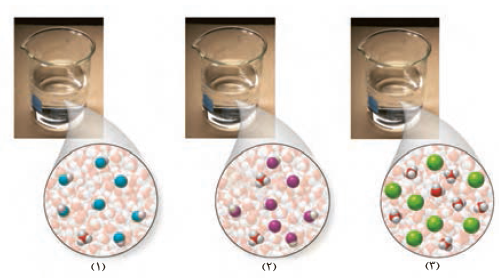
بر اساس مقدار ثابت یونش محلول (۳) با هیدروبرمیک اسید ، محلول (۲) با استیک اسید ، و محلول (۱) با هیدروسیانیک اسید همخوانی دارد . زیرا برای اسیدهای تک پروتون دار هرچه غلظت یون هیدرونیوم بیشتر باشد ، ثابت یونش بزرگتر است .
جواب صفحه ۳۴ شیمی دوازدهم
۴- رنگ گل ادریسی به میزان اسیدی بودن خاک بستگی دارد . این گل در خاکی که غلظت یون هیدرونیوم آن ۵-۱۰´۲ مول بر لیتر است به رنگ آبی اما در خاک دیگری که غلظت یون هیدرونیوم ۹-۱۰´۴ مول بر لیتر است به رنگ سرخ شکوفا می شود. pH این دو نوع خاک را حساب کنید.

$pH=-\log [{{H}^{+}}]=-\log (2\times {{10}^{-5}})=4/7$
$pH=-\log [{{H}^{+}}]=-\log (4\times {{10}^{-9}})=8/4$
۵ــ دانش آموزی برای نشان دادن ارتباط بین حاصل ضرب غلظت یون های هیدرونیوم و هیدروکسید با حجم محلول، شکل های ب تا ت را پیشنهاد داده است.
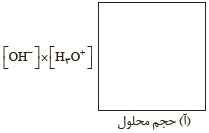
کدامیک از این شکل ها ارتباط بین کمیت های داده شده را به درستی نشان می دهد؟
با توجه به اینکه در دمای ثابت برای محلولهای آبی حاصلضرب $[{{H}^{+}}][O{{H}^{-}}]$ همواره مقدار ثابتی است، از اینرو با تغییر حجم محلول، حاصلضرب غلظت این یونها ثابت میماند در واقع نمودار (پ) برای این توصیف مناسب است.
۶- در نمونه ای از عصارۀ گوجه فرنگی، غلظت یون هیدرونیوم ۱۰۶ ×۴برابر غلظت یون هیدروکسید است. pHآن را حساب کنید و در جای خالی بنویسید.

$[{{H}_{3}}{{O}^{+}}]=4\times {{10}^{6}}[O{{H}^{-}}]\Rightarrow [O{{H}^{-}}]=\frac{[{{H}_{3}}{{O}^{+}}]}{4\times {{10}^{6}}}$
$[{{H}_{3}}{{O}^{+}}][O{{H}^{-}}]={{10}^{-14}}$
$[{{H}_{3}}{{O}^{+}}]\frac{[{{H}_{3}}{{O}^{+}}]}{4\times {{10}^{6}}}={{10}^{-14}}\Rightarrow {{[{{H}_{3}}{{O}^{+}}]}^{2}}=4\times {{10}^{6}}\times {{10}^{-14}}=4\times {{10}^{-8}}$
$[{{H}_{3}}{{O}^{+}}]=2\times {{10}^{-4}}$
$pH=-\log [{{H}_{3}}{{O}^{+}}]=-(\log 2+\log {{10}^{-4}})=-(\log 2-4\log 10)\Rightarrow pH=-(0/3-4)=3/7$
جواب صفحه ۳۵ شیمی دوازدهم
۷- pH یک نمونه از آب سیب برابر با ۴/۷ است. نسبت غلظت یون های هیدرونیوم به یون های هیدروکسید را در این نمونه حساب کنید.
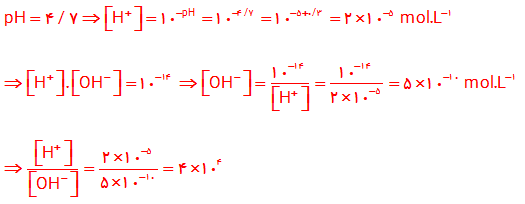
۸- هر یک از شکل های زیر ۵۰۰ میلی لیتر از محلول آبی یک حل شونده را نشان می دهد.

آ) این حل شونده ها اسید آرنیوس هستند یا باز آرنیوس؟ چرا؟
اسید آرنیوس ، زیرا با حل شدن در آب باعث افزایش غلظت یون هیدرونیوم شده اند .
ب) درجه یونش و pH را برای هر یک از آنها حساب کنید (هر ذره را ۰/ ۰۰ ۱ مول از آن گونه در نظر بگیرید).
شکل (۱):
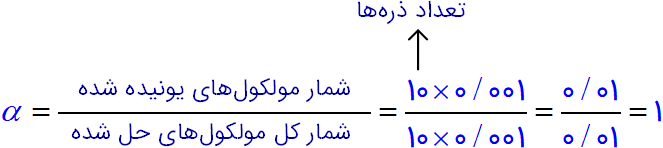
$pH=-\log [{{H}_{3}}{{O}^{+}}]=-\log 0/01=-(\log 1-\log 100)=-(0-2\log 10)=2$
شکل (۲):
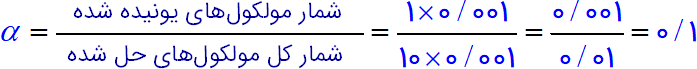
$pH=-\log [{{H}_{3}}{{O}^{+}}]=-\log 0/001=-(\log 1-\log {{10}^{3}})=-(0-3\log 10)=3$
۹- HX و HY دو اسید ضعیف هستند. اگر ۱۲ گرم از HX و ۸ گرم از HY جداگانه در ۱ لیتر آب حل شوند، pH این دو محلول برابر خواهد شد. با مقایسه درجه یونش آن ها مشخص کنید کدام اسید قوی تر است؟ چرا؟ (1mol HX = 150 g, 1mol HY = 50g)
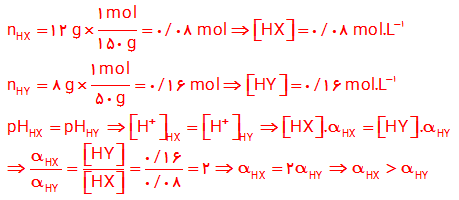
۱۰- یک کارشناس شیمی، pH نمونه هایی از ۲۰۰ لیتر محلول تهیه شده ( ۱ و ۲ ) را اندازه گیری کرده است. حساب کنید، چه جرمی از هر ماده حل شونده به ۲۰۰ لیتر آب افزوده شده است؟ از تغییر حجم چشم پوشی کنید.

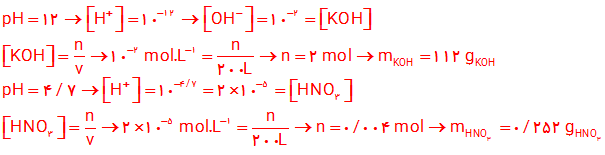
$pH=12\to [{{H}^{+}}]={{10}^{-12}}\to [O{{H}^{-}}]={{10}^{-2}}=[KOH]$
$112gKOH$ یا $[KOH]=\frac{n}{v}\to {{10}^{-2}}mol{{L}^{-1}}=\frac{n}{200L}\to n=2mol$
$pH=4/7\to [{{H}^{+}}]={{10}^{-pH}}={{10}^{-4/7}}={{10}^{0/3}}\times {{10}^{-5}}=2\times {{10}^{-5}}mol{{L}^{-1}}$
$۰/252gHN{{O}_{3}}$ یا $[HN{{O}_{3}}]=\frac{n}{v}\to 2\times {{10}^{-5}}mol{{L}^{-1}}=\frac{n}{200L}\to n=0/004mol$
جواب صفحه ۳۶ شیمی دوازدهم
۱۱- با توجه به شکل زیر که نمای ذره ای از یک واکنش را نشان می دهد، به پرسش ها پاسخ دهید.
آ( هر یک از جاهای خالی را با فرمول شیمیایی مناسب پر کنید.
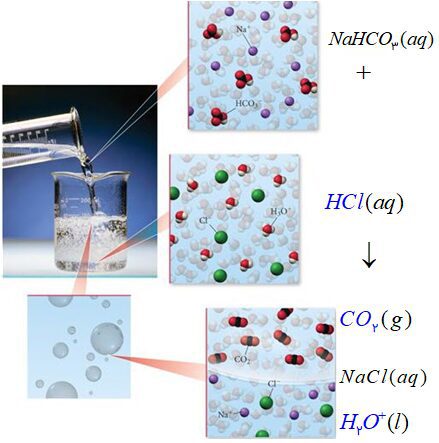
ب( از واکنش ۱۰۰ میلی لیتر محلول هیدروکلریک اسید ۰/۲ مول بر لیتر با مقدار کافی از سدیم هیدروژن کربنات، چند میلی لیتر گاز کربن دی اکسید در STP تولید می شود؟
$?LC{{O}_{2}}=0/1LA(aq)\times \frac{0/1molA}{1LA(aq)}\times \frac{1molC{{O}_{2}}}{1molA}\times \frac{22/4LC{{O}_{2}}}{1molC{{O}_{2}}}=0/224LC{{O}_{2}}$
۱۲- ثابت یونش برای محلول های BOH(aq) و B’OH(aq) در دمای اتاق به ترتیب برابر با ۱/۸´۱۰-۵ و ۴/۸´۱۰-۴ است.
آ) کدام یک باز قوی تری است؟ چرا؟
می دانیم که هرچه ثابت یونش یک باز بیشتر باشد، باز قوی تر خواهد بود. در نتیجه محلول B’OH باز قوی تر است.
ب) pH کدام محلول کمتر است؟ چرا؟
محلول BOH باز ضعیفی است. در نتیجه غلظت یون هیدرونیوم آن به مراتب از محلول دیگری بیشتر است. در نتیجه pH کمتری دارد.
برای مشاهده گام به گام سایر صفحات کتاب کافیست آن را در گوگل به همراه عبارت «حالا درس» جست و جو کنید.

۱۰ دیدگاه ها
۵ و ۸ و۱۱ غلط
لطفاً جواب رو درست کنید سوال ۸و ۱۱ و۵ جوابشون غلطه
تشکر زیاد عالی بود
نه
سلام سوال ۸ ایراد داره ، اولی ۰٫۰۲ و دومی ۰٫۰۰۲ میشود
بیشتر توضیح بدین
دید
خیر، درست هست
اره دقیقا
عالی بود ممنون