جواب خود را بیازمایید صفحه ۲۴ و ۲۵ شیمی یازدهم

در این نوشته با جواب خود را بیازمایید صفحه ۲۴ و ۲۵ شیمی یازدهم رشته تجربی و ریاضی همراه شما هستیم.
جواب صفحه ۲۴ شیمی یازدهم
۱- یکی از واکنشهایی که در صنعت جوشکاری از آن استفاده میشود واکنش ترمیت است.
۲Al (s) + Fe2O3 (s) → Al2O3 (s) + 2Fe (s)
الف) مشخص کنید کدام فلز فعالتر است، آلومینیم یا آهن. چرا؟
آلومینیم، زیرا توانسته آهن را از ترکیب Fe۲O۳ خارج کند و واکنش انجامپذیر میباشد.
پاسخی دیگر:آلومینیم، چون توانسته در واکنش با آهن تولید یک ترکیب (آلومینیم اکسید) کند و واکنش انجام شود پس واکنش پذیری عنصر آلومینیم از عنصرآهن بیشتر است
ب) حساب کنید برای تولید ۲۷۹ گرم آهن، چند گرم آلومینیم با خلوص ۸۰ درصد لازم است.
$\begin{align}
& ?g \\
& 80% \\
\end{align}$
$?gAl=279Fe\times \frac{1molFe}{56gFe}\times \frac{2molAl}{2molFe}\times \frac{27gAl}{1molAl}\times \frac{100}{80}=168/14gAl$
جواب صفحه ۲۵ شیمی یازدهم
۲- آهن (ΙΙΙ) اکسید به عنوان رنگ قرمز در نقاشی به کار میرود. از واکنش ۱۰ کیلوگرم از این ماده با گاز کربن مونوکسید طبق معادلۀ زیر، ۵۲۰۰ گرم آهن به دست آمده است. بازده درصدی واکنش را به دست آورید.
$F{{e}_{2}}{{O}_{3}}(s)+3CO(g)\to 2Fe(s)+3C{{O}_{2}}(g)$
$?gFe=10kgF{{e}_{2}}{{O}_{3}}\times \frac{1000gF{{e}_{2}}{{O}_{3}}}{1kgF{{e}_{2}}{{O}_{3}}}\times \frac{1molF{{e}_{2}}{{O}_{3}}}{160gF{{e}_{2}}{{O}_{3}}}\times \frac{2molFe}{1molF{{e}_{2}}{{O}_{3}}}\times \frac{56gFe}{1molFe}=7000gFe$
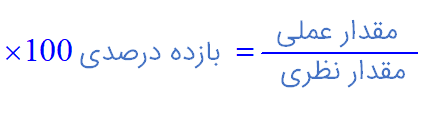
$=\frac{5200}{7000}\times 100=74/28%$ بازده درصدی
۳- یکی از روشهای بیرون کشیدن فلز از لابهلای خاک، استفاده از گیاهان است. در این روش در معدن یا خاک دارای فلز، گیاهانی را میکارند که میتوانند آن فلز را جذب کنند. سپس گیاه را برداشت میکنند، میسوزانند و از خاکستر حاصل، فلز را جداسازی میکنند. در جدول زیر، دادههایی دربارۀ این روش ارائه شده است. با توجه به آن:
| نماد شیمیایی فلز | قیمت هر کیلوگرم فلز (ریال) | بیشترین مقدار فلز در یک کیلوگرم از گیاه (گرم) | درصد فلز در سنگ معدن |
|---|---|---|---|
| Au | ۱۲۰۰۰۰۰۰۰۰ | ۰/۱ | ۰/۰۰۲ |
| Ni | ۸۲۰۰۰۰ | ۳۸ | ۲ |
| Cu | ۲۴۵۰۰۰ | ۱۴ | ۰/۵ |
| Zn | ۱۵۵۰۰۰ | ۴۰ | ۵ |
الف) در صورتی که در پالایش طلا به کمک گیاهان، در هر هکتار بتوان ۲۰ تن گیاه برداشت کرد. حساب کنید در هر هکتار چند گرم طلا از زمین بیرون کشیده میشود.
$?gAl=20ton\times \frac{1000kg}{1ton}\times \frac{0/11gAu}{1kg}=2000gAu$
ب) یک کیلوگرم از گیاهی که برای پالایش نیکل به کار میرود، ۱۵۹ گرم خاکستر میدهد. درصد نیکل را در این خاکستر حساب کنید.
درصد خلوص $Ni=\frac{38}{159}\times 100=23/89%$
پ) چرا این روش برای استخراج فلزهای روی و نیکل مقرون به صرفه نیست؟
با توجه به درصد بالای فلز در سنگ معدن، نسبت به مقدار استخراج شده با روش سوزاندن گیاه، از لحاظ اقتصادی استخراج از طریق کشت گیاهان مقرون به صرفه نمیباشد.
برای مشاهده گام به گام سایر صفحات کتاب کافیست آن را در گوگل به همراه عبارت «حالا درس» جست و جو کنید.

2 دیدگاه ها
عالی ممنون
عالی